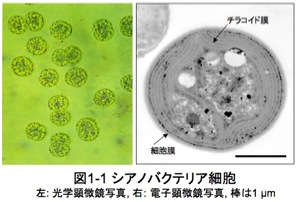
私たちが研究材料に用いているのは、シアノバクテリア(cyanobacteria)と呼ばれるグラム陰性の原核光合成微生物です (図1-1)。高校の教科書では、藍藻(ラン藻, blue-green algae)などと呼ばれていますが、藻類(真核光合成生物)ではなく、微生物(バクテリ
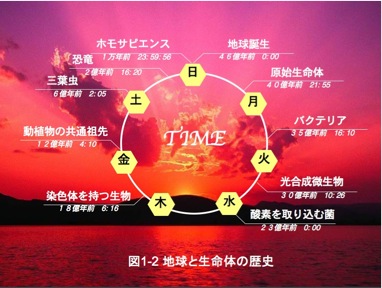
一方、地球と生命体の歴史からこの生物をとらえた場合(図1-2)、実に重要な位置付けにいます。原始地球の大気に酸素はほとんど存在しませんでしたが、酸素発生型の光合成を行うシアノバクテリアが30億年近く前に出現し、大繁栄したことによって酸素を放出し、還元的な地球を酸化的な環境に変えたと考えられています。またシアノバクテリアは、細胞内共生によって真核生物に取り込まれ「葉緑体」(光合成の場)の起源となりました。光合成の明反応は、チラコイド膜と呼ばれる多重の内膜上で行われるのが特徴です。光合成では、無機物の水(H2O)と
シアノバクテリアが分子生物学の研究材料に適している理由としては、培養が容易であり、細胞から遺伝子の抽出や改変した遺伝子を細胞に導入する技術が確立されていることがあげられます。加えて1996年にはシアノバクテリアの一種である 単細胞性 Synechocystis PCC6803 (図1-1右)のゲノム全塩基配列が決定されたことを初めとし、その後、糸状性や好熱性あるいは海洋性といった様々なシアノバクテリアのゲノム解読も飛躍的に進みました。その結果、データベース化された膨大な遺伝情報の中から目的遺伝子の情報を取り出し、遺伝子機能解析に利用することが容易になりました。このような背景から、シアノバクテリアは「生命現象」や「環境」ならびに「資源」の諸問題について研究するための優れたモデル光合成生物になっています。
・研究概要
私たちグループでは、シアノバクテリアにおける「光応答」や「窒素・炭素代謝」遺伝子の発現調節について、転写(transcription)と 転写後(post-transcription)レベルで働く制御因子の機能解析を行っています。またこれら基礎研究から得られた成果を基盤にして光合成産業や環境汚染感知システム構築に役立てる応用研究もしています。
(1)RNAポリメラーゼのシグマ因子
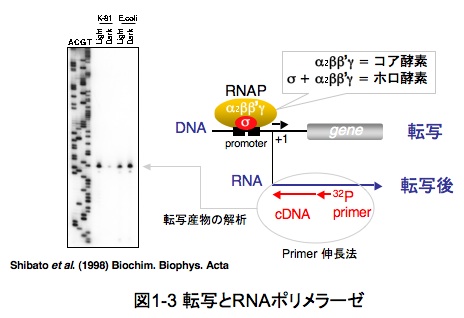
ゲノムDNA上に記された遺伝情報の発現は、基本的には「転写」から「翻訳」反応を経て進み、合成された RNAやタンパク質が必要に応じて細胞内で機能することにより成し遂げられます。転写は、ゲノムDNAからRNAにいったん遺伝情報を書き写す作業であって、RNAポリメラーゼ(RNA polymerase, RNAP)という複合酵素が転写装置の本体です。シアノバクテリアRNAP複合酵素は、コア酵素(α2, β, β’, γ)とサブユニットの一つである「σ因子」(sigma factor)が合わさってホロ酵素となり初めて機能します(図1-3)。
私たちは、共同研究者とも協力してモデル光合成生物シアノバクテリアPCC6803における全9種類のシグマ因子の発現と機能解析を行っています。私たちグループは、9種類全てのシグマ因子遺伝子の精製タンパク質と抗体を揃えたり、生育に必須なSigAを除き、残り8種類のシグマ因子遺伝子破壊株を取得したり、さらには
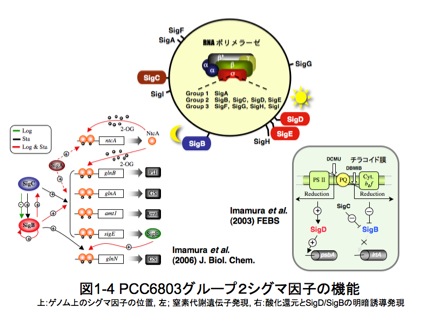
このように「グループⅡシグマ因子同士は、共存協調しあいながらも各自の個性を生かし、環境変化に応じて転写開始反応がなされるよう、それぞれが役割分担して目的遺伝子のプロモーターを認識していること」が明らかになっています。一方、グループⅢシグマ因子は、比較的小さな分子量でユニークな分子構造をしていますが、プロモーター認識能については殆どわかっていません。そこで現在私たちはその点を含め、PCC6803シグマ因子の発現調節ネットワークについて解析を進めています。近い将来、シアノバクテリアの転写開始を司るシグマ因子の機能について、全体像が掴めるのではないかと考えています。
(2)AU-box配列とRNA分解酵素
遺伝子発現において、転写された後の「RNA分子の安定性(寿命)」は、翻訳量を左右する重要な要素です。どんなにたくさん転写されても、合成されたRNAが分解されてしまえば、翻訳に使われるRNA量は少なくなってしまいます。 逆に、外部環境の変化に応じて細胞内では、合成された過剰量のRNAを分解し消化することも必要です。例えば光合成遺伝子は、日中mRNAが活発に合成されますが、夕方から夜にかけてmRNA量は減少します。光に反応して光合成遺伝子mRNAが増加する一因として、「光誘導性シグマ因子」による転写段階での「正」の制御が必要なことは先に述べましたが、一方でmRNAを分解する仕組みについて知る必要があります。
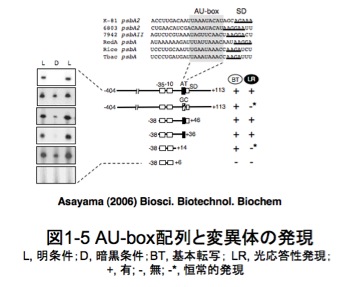
私たちのグループでは、必須光合成遺伝子 psbAをモデルとして、シアノバクテリアPCC6803において暗黒培養条件下で働く「RNA分解酵素(リボヌクレアーゼ, RNase)」による「負」の制御について研究しています。私たちは、psbA遺伝子mRNAの非翻訳領域(5'-untranslated leader region, 5'-UTR)に、「5’-UAAAUAAA-3’」という光応答性遺伝子に共通の配列が存在することを発見し、これをAU-box配列と名付けました(図1-5)。面白いことにAU-box配列を欠失させたり、GC配列に改変したりすると、変異psbA 遺伝子の発現は暗黒条件下でも安定し、その結果、mRNAを多量に蓄積するようになります。つまり、AU-box配列が、mRNAの不安定性に関与しているわけです。
そこで私たちは、シアノバクテリア PCC6803において、psbA遺伝子の
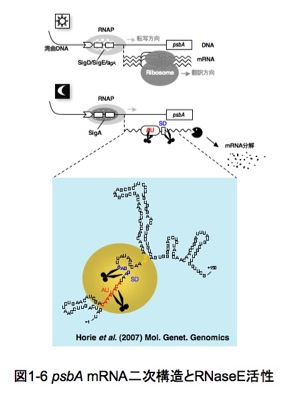
これらの結果は、「実際の細胞内では夕刻になるとRNaseE活性が増し、psbA遺伝子のmRNAがAU-box配列のところから分解されてゆく」という「負」の調節を想像させます。 これまで光合成生物おいて、暗黒下でのmRNAの分解機構についてはあまり知見が知られていなかったので、今後、RNaseEを介した新たな分解機構の研究が発展することを期待しつつ、現在研究を続けています。
以上をまとめると、シアノバクテリアの光応答性遺伝子発現は、転写段階での光誘導性シグマ因子による「正」の制御と、転写後、RNaseEによる「負」の制御による二段階で制御されているようです。二段階調節機構のモデル(図1-6)を提唱するに至った研究経緯については、総説の中で述べています。
(3)ベントDNA構造とプロモーター配列
光によって転写が誘導されるシアノバクテリア psbA 遺伝子上流の塩基配列を眺めていると、アデニンとチミンの連なり(tract, n≧3)が並んでいるということに気づきます。通常DNAは、持続長(persistence length, 150〜200 bp)の長さよりも短くなると分子形状は概ね直線になりますが、特定の配列がらせん周期(10.5 bp)とほぼ同じ周期で規則的に分布しているような場合、らせん軌道が曲がった構造をとることがあります。このようなDNAは湾曲 (bent) DNAと呼ばれ(curved DNA, intrinsic DNAとも呼ばれる)、プロモーター上流に存在する場合は3次元的に右向きにねじれていることが多いとされています(図1-7左上)。一方、RNAPを含めた転写調節蛋白質の標的DNA領域への結合により生じるDNAの曲がりは、protein-induced DNA bendingと呼ばれ、前者とは区別されます。 RNAPは、右向きのベントDNAを好んでプロモーター領域に結合するとDNAを左向きにねじる習性があるようです。その結果生じる歪みが、転写反応開始の際、二本鎖DNAの一本鎖への解離を促進させ mRNA合成に有利に働くとされています(図1-7左上)。このようにベントDNAは、RNAPのプロモーター領域への結合やそれに続く転写の各段階に貢献するシス因子として知られています。

私たちグループは、既に1999年の時点で、霞ヶ浦より単離したシアノバクテリアの一種 Microcystis aeruginosa K-81の主要シグマ因子遺伝子rpoD1の上流に見出された右向きのベントDNAの転写に及ぼす機能を、光合成生物において初めて明らかにしていましたが、光応答性 psbA2遺伝子上流に発見していたベントDNAの機能に関しては全くわかっていませんでした。 Crotherらが考案したcircular permutationアッセイ法を用いて、psbA2のベントDNAの中心部位を決定したところ、転写開始点(+1)から上流約-180から-140とプロモーター配列(-35, -10付近)よりもかなり上流に位置していることがわかりました。さらにこのベントの中心は、温度依存的にシフトする極めてユニークな構造をしており CIT (changeable bending-center sites of an intrinsic curvature under temperature conditions)と名付けられました。ベントDNAが他の光合成生物にも保存されているか調べたところ、真核光合成微生物である紅藻 (red algae)、単子葉や双子葉の高等植物 psbA遺伝子の上流にも発見されました。この事実は、psbAのベントDNAが進化的に保存されていることを示唆しています。 psbA2遺伝子の野生型ベントDNA (wtCIT)領域の塩基配列を置換してベントDNA構造を破壊した変異体 (cdCIT)を取得し、シアノバクテリア細胞内で転写に与える影響を調べました。その結果、CIT破壊株でもpsbA2の光誘導性発現は観察されましたが、転写産物量そのものは全体的に現象していたので(図1-7左)、CITは「基本転写」に対し「正」の働きをしていることが明らかになりました。一方、RNAPによる psbA2 プロモーター周辺領域への結合を詳細に解析したところ、RNAP 自身の結合により誘導される蛋白質誘導型DNAベンディングも発見され、これを RIB (RNAP-induced DNA bending) (図1-7左)と名付けました。さらに RIB が psbA2 遺伝子の「基本転写」に必須であることを証明しました。原核生物におけるベントDNAと転写におよぼす機能関しては、総説本にまとめているのでそちらをご覧ください (図1-7右)。
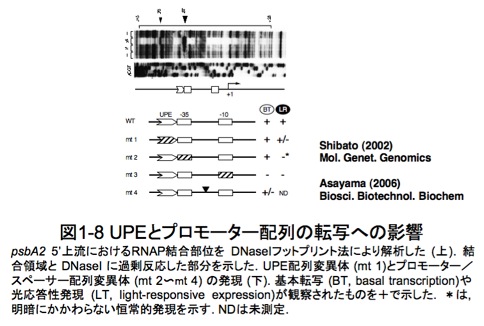
シアノバクテリア psbA 遺伝子プロモーターの -35配列のすぐ上流には、TyAsAAAsyyC (s = GかC, y = TかC)をモチーフとするUPE (upstream element)が共通配列として保存されています。大腸菌では、-35プロモーターの直上流の配列が、RNAPのコア酵素であるαサブユニット(RpoA)のカルボキシ末端 (α-CTD)と相互作用したり、転写調節蛋白質の結合部位だったりします。しかし、シアノバクテリア psbAのUPEの機能に関しては未知だったので、UPEやプロモーターおよびスペーサー配列の変異体を作製し、発現に与える影響を in vitro (試験管内の人工的な環境下)と in vivo (細胞内)でそれぞれ解析しました(図1-8)。その結果、UPEは光誘導性の転写発現に「正」に働くシス配列であることが明らかになりました。しかし、UPEを標的として結合する調節蛋白質が存在するか否かは現在のところ不明です。一方、psbA遺伝子プロモーター配列とスペーサー(-35から-10までの間)の機能についても、変異体を作製して詳細に解析しました。その結果、-10プロモーター配列は「基本転写」に必須であり、-35プロモーター配列は「基本転写」に必須ではないが、光誘導性や概日性リズムの発現に影響を与える配列でした。さらにRNAPのpsbA2 プロモーター領域への結合を DNase I フットプリント法で解析したところ、結合領域は -115 から +23であり、-70 と -37の部分がDNaseに対して特に感受性になっていました。このことは、RNAP結合部位が遺伝子のかなり上流にまで及んでいることと、RNAPが結合した際、-35プロモーター部位の直上流でDNAの構造が大きく変化している可能性を示しています。
(4)発現ベクター開発と光合成産業
光合成微生物シアノバクテリアの転写と転写後段階におけるこれまでの基礎研究から、遺伝子発現にはDNA/RNAの配列(UPE, プロモーター, AU-box)や
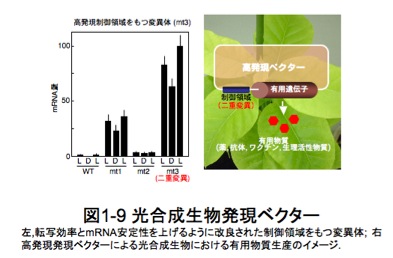
これらcis-エレメントとtrans-アクティング因子を上手く組み合わせて光合成生物特有の発現ベクターを構築すれば、光培養条件(光量・光質)を制御しながら、組み換え光合成微生物や植物葉緑体内で、生理活性物質やワクチンなど薬や抗体を大量生産し、安全かつ効率よく回収することができるかもしれません。例えば、シアノバクテリアpsbA 遺伝子のプロモーター配列とAU-box配列を同時に変異させた二重変異体でのmRNA発現量は、野生型のそれと比較すると何十倍にも増加することを私たちは見出しています(図1-9)。現在、こうした高発現系に貢献する配列や因子の組み合わせを選定し、光合成生物発現プラスミドベクターを構築中です。将来、シアノバクテリアや藻類、あるいは植物において有用物質を高発現させることのできる夢の技術に発展することを期待しています。
一方、約30数億年前に出現し大繁栄したシアノバクテリアの遺骸は、
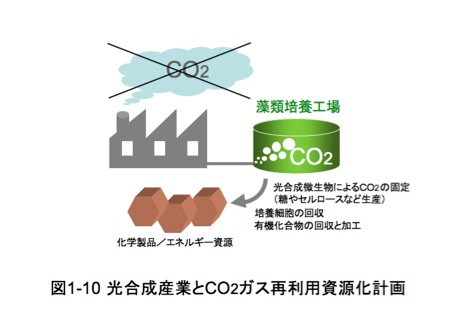
(5)新規光合成微生物探索と環境評価
この研究は、新技術開発財団からの支援を受けて行っています。
